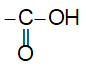Bạn đang tìm kiếm Hóa học 11 Bài 45: Axit cacboxylic – Giải bài tập SGK Hóa học 11 Bài 45 2023 phải không? Xin chúc mừng bạn đã tìm đúng chỗ rồi! Hãy đọc ngay bài viết dưới đây của Tekmonk
Hóa học 11 Bài 45: Axit cacboxylic được Tekmonk hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 45
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa, cấu tạo
– Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
– Nhóm
được gọi là nhóm cacboxyl, viết gọn là -COOH.
– Nhóm –OH và nhóm >C=O lại có ảnh hưởng qua lại lẫn nhau:
– Liên kết giữa H và O trong nhóm –OH phân cực mạnh, nguyên tử H linh động hơn trong ancol, anđehit và xeton có cùng số nguyên tử C.
2. Phân loại
– Nếu nhóm cacboxyl liên kết trực tiếp với nguyên tử hiđro hoặc gốc ankyl thì tạo thành dãy axit no, mạch hở, đơn chức, công thức chung là CnH2n+1COO, gọi là dãy đồng đẳng của axit fomic (HCOOH). Ví dụ: CH3COOH (axit axetic), CH3CH2COOH (axit propionic), …
– Nếu gốc hiđrocacbon trong phân tử axit có chứa liên kết đôi, liên kết ba thì gọi là axit không no. Ví dụ CH2=CH-COOH.
– Nếu gốc hiđrocacbon là vòng thơm thì gọi là axit thơm, ví dụ C6H5-COOH (axit benzoic), …
– Nếu trong phân tử có nhiều nhóm cacboxyl (-COOH) thì gọi là axit đa chức. Ví dụ: HOOC-COOH (axit oxalic), HOOCCH2COOH (axit malonic), …
3. Danh pháp
– Tên thay thế: Tên gọi = axit + tên hiđrocacbon no tương ứng với mạch chính + “oic”.
VD:
– Tên thông thường: Xuất phát từ nguồn gốc tìm ra chúng.
VD: HOOC-COOH: axit oxalic
HOOC-CH2-COOH: axit malonic.
HOOC-[CH2]4-COOH: axit ađipic.
Tên một số axit thường gặp
| Công thức | Tên thông thường | Tên thay thế |
|---|---|---|
| H-COOH CH3-COOH CH3CH2-COOH (CH3)2CH-COOH CH3 (CH2 )3-COOH CH2=CH-COOH CH2=C(CH3)-COOH HOOC-COOH C6H5-COOH | Axit fomic Axit axetic Axit propionic Axit isobutiric Axit valeric Axit acrylic Axit metacrylic Axit oxalic Axit benzoic | Axit metanoic Axit etanoic Axit propanoic Axit 2-metylpropanoic Axit pentanoic Axit propenoic Axit 2-metylpropenoic Axit etanđioic Axit benzoic |
II. Tính chất vật lý
– Ở ĐK thường các axit cacboxylic đều là những chất lỏng hoặc rắn.
– Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M: nguyên nhân là do giữa các phân tử axit cacboxylic có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
– Axit cacboxylic cũng tạo liên kết hiđro với nước và nhiều chất khác. Các axit fomic, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan trong nước giảm.
– Mỗi axit cacboxylic có vị chua riêng biệt như axit axetic có vị chua giấm, axit xitric có vị chua chanh, axit oxalic có vị chua me, axit tactric có vị chua nho…
III. Tính chất hóa học
1. Tính axit và ảnh hưởng của nhóm thế
– Trong dung dịch, axit cacboxylic phân li thuận nghịch:
– Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazơ, oxit bazơ tạo thành muối và nước:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
– Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
– Tác dụng với kim loại trước hiđro:
2CH3COOH + Zn → (CH3COO)2Zn + H2
2. Phản ứng tạo thành dẫn xuất axit
a. Phản ứng thế nhóm –OH: Phản ứng giữa axit và ancol được gọi là phản ứng este hóa.
Chiều thuận là phản ứng este hoá, chiều nghịch là phản ứng thuỷ phân este.
Phản ứng thuận nghịch, xúc tác H2SO4 đặc.
b. Phản ứng tách nước liên phân tử
Khi dùng xúc tác P2O5, hai phân tử axit tách đi một phân tử nước tạo thành phân tử anhiđrit axit.
Ví dụ:
3. Phản ứng ở gốc hidrocacbon
a. Phản ứng thế ở gốc no
Khi dùng photpho (P) làm xúc tác, Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl.
b. Phản ứng thế ở gốc thơm
Nhóm cacboxyl ở vòng benzen định hường cho phản ứng thế tiếp theo vào vị trí meta và làm cho phản ứng khó khăn hơn so với thế vào benzen:
c. Phản ứng cộng vào gốc không no
Axit không no tham gia phản ứng cộng H2, Br2, Cl2, … như hiđrocacbon không no.
IV. Điều chế, ứng dụng
a. Điều chế
– Phương pháp lên men giấm:
C2H5OH + O2 → CH3COOH + H2O
– Oxi hóa anđehit axetic:
– Oxi hóa ankan:
Ví dụ:
– Từ metanol:
b. Ứng dụng
– Axit axetic:
+ Axit axetic được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4-D; 2,4,5-T …), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số este (làm dược liệu, hương liệu, dung môi, …), xenlulozơ axetat (chế tơ axetat), …
– Các axit khác:
+ Các axit béo như axit panmitic (n-C15H31COOH), axit stearic (n-C17H35COOH), … được dùng để chế xà phòng. Axit benzoic được dùng trong tổng hợp phẩm nhuộm, nông dược, … Axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau, …
+ Các axit đicacboxylic (như axit ađipic, axit phtalic, …) được dùng trong sản xuất poliamit, polieste để chế tơ sợi tổng hợp.
Giải bài tập SGK Hóa học 11 Bài 45
Bài 1 (trang 210 SGK Hóa 11)
Thế nào là axit cacbonxylic? Viết công thức cấu tạo, gọi tên các axit có công thức phân tử C4H8O2.
Lời giải:
– Định nghĩa axit cacboxylic : là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon(1) hoặc nguyên tử hiđro.
((1): Nguyên tử cacbon này có thẻ của gốc hiđrocacbon hoặc của nhóm -COOH khác.)
Bài 2 (trang 210 SGK Hóa 11)
Từ công thức cấu tạo, hãy giải thích tại sao axit fomic có tính chất của một anđehit.
Lời giải:
Do phân tử có nhóm –CHO nên axit fomic có tính chất của 1 anđehit
Bài 3 (trang 210 SGK Hóa 11)
Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra.
Lời giải:
Bài 4 (trang 210 SGK Hóa 11)
Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit
B. Axit.
C. Ancol
D. Xeton
Lời giải:
– Đáp án B.
– Phương trình minh họa:
CH3CH2CH2COOH + NaOH → CH3CH2CH2COONa + H2O
Bài 5 (trang 210 SGK Hóa 11)
Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
Lời giải:
Gọi công thức phân tử của X là CnH2n+1COOH (n ≥ 1)
nNaOH = 0,1. 1,5 = 0,15(mol)
Phương trình phản ứng:
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
Theo phương trình: nCnH2n+1COOH = nNaOH = 0,15 (mol)
⇒ MX =
= 74
⇒ 14n + 46 = 74
⇒ n=2 ⇒ X: C2H5COOH (axit propanoic)
Bài 6 (trang 210 SGK Hóa 11)
Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a. Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b. Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Lời giải:
a) Gọi số mol của axit axetic và axit fomic lần lượt là x và y (mol)
Phương trình hoá học ở dạng phân tử:
Phương trình hoá học ở dạng ion:
CH3COOH + OH– → CH3COO– + H2O
HCOOH + OH– → HCOO– + H2O
b) Theo đề bài ta có hệ phương trình:
Bài 7 (trang 210 SGK Hóa 11)
Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác ). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a. Viết phương trình hóa học của phản ứng.
b. Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
Lời giải:
a) Phương trình hóa học:
CH3COOH + C2H5OH —H2SO4→ CH3COOC2H5 + H2O
b)
Trắc nghiệm Hóa học 11 Bài 45 có đáp án
Bài 1: Axit malonic có công thức là
A. CH3-COOH.
B. CH2=CH-COOH.
C. C6H5-COOH.
D. HOOC-CH2-COOH.
Lời giải
Đáp án: D
Bài 2: Axit acrylic (CH2=CH-COOH) không có khả năng phản ứng với dung dịch
A. Na2CO3.
B. Br2.
C. NaCl.
D. Ca(HCO3)2.
Lời giải
Đáp án: C
Bài 3: Đốt cháy hoàn toàn x mol axit cacboxylic E, thu được y mol CO2 và z mol H2O (với z = y – x). Cho x mol E tác dụng với NaHCO3 (dư) thu được y mol CO2. Tên gọi của E là
A. axit oxalic.
B. axit acrylic.
C. axit ađipic.
D. axit fomic.
Lời giải
Đáp án: A
Bài 4: Trung hòa 3,88 gam hỗn hợp X gồm hai axit cacbocylic no, đơn chức, mạch hở bằng dung dịch NaOH, cô cạn toàn bộ dung dịch sau phản ứng thu được 5,2 gam muối khan. Nếu đốt cháy hoàn toàn 3,88 gam X thì thể tích oxi (đktc) cần dùng là
A. 2,24 lít.
B. 4,48 lít.
C. 1,12 lít.
D. 3,36 lít.
Lời giải
Đáp án: D
RCOOH + Na → RCOONa
1 mol axit → 1 mol muối tăng 22g
⇒ naxit = (5,2 – 3,88)/22 = 0,06 mol
Gọi công thức trung bình của 2 axit là:
MX = 14ntb + 32 = 3,88 : 0,06 = 194/3 ⇒ ntb = 7/3
⇒ V = 3,36l
Bài 5: Hỗn hợp X gồm axit axetic, axit fomic và axit oxalic. Khi cho m gam X tác dụng với NaHCO3 (dư) thì thu được 15,68 lít khí CO2 (đktc). Mặt khác, đốt cháy hoàn toàn m gam X cần 8,96 lít khí O2 (đktc), thu được 35,2 gam CO2 và y mol H2O (đktc). Giá trị của y là
A. 0,2.
B. 0,3.
C. 0,6.
D. 0,8.
Lời giải
Đáp án: C
X + NaHCO3 → CO2
H+ + HCO3– → CO2 + H2O
nCO2 = nH+ = 0,7 mol
Ta có: nO(axit) = 2 nH+ = 1,4 mol
Bảo toàn nguyên tố oxi: nO (axit) + 2nO2 = 2nCO2 + nH2O
⇒ 1,4 + 0,4.2 = 0,8.2 + y ⇒ y = 0,6 mol
Bài 6: Hóa hơi 15,52 gam hỗn hợp gồm một axit no đơn chức X và một axit no đa chức Y (số mol X lớn hơn số mol Y), thu được một thể tích hơi bằng thể tích của 5,6 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Nếu đốt cháy toàn bộ hỗn hợp hai axit trên thì thu được 10,752 lít CO2 (đktc). Công thức cấu tạo của X, Y lần lượt là
A. H-COOH và HOOC-COOH.
B. CH3-COOH và HOOC-CH2-CH2-COOH.
C. CH3-CH2-COOH và HOOC-COOH.
D. CH3-COOH và HOOC-CH2-COOH.
Lời giải
Đáp án: D
nN2 = naxit = 0,2 mol
Gọi X là CnH2nO2 (x mol)
Y là CmH2m-2O4 (y mol)
x + y = 0,2 mol
x(14n + 32 ) + y(14m + 62) = 15,52
xn + ym = nCO2 = 0,48
⇒ x = 0,12; y = 0,08
⇒ 3n + 2m = 12
Ta có: n, m > 2 ⇒ n = 2 và m = 3.
Bài 7: Hỗn hợp X gồm hai axit cacbocylic no, mạch hở Y và Z (phân tử khối của Y nhỏ hơn Z). Đốt cháy hoàn toàn a mol X, sau phản ứng thu được a mol H2O. Mặt khác, nếu cho a mol X tác dụng với lượng dư dung dịch NaHCO3, thì thu được 1,6a mol CO2. Thành phần phần trăm theo khối lượng của Y trong Z là
A. 46,67%.
B. 40,00%.
C. 25,41%.
D. 74,59%.
Lời giải
Đáp án: C
a mol X → a mol H2O ⇒ Số H trung bình trong X = 2
⇒ Y là HCOOH (x mol) và Z là: (COOH)2 (y mol)
nCO2 = nH+ = 1,6a ⇒ x + 2y = 1,6a (1)
x + y = a (2)
Từ (1)(2) ⇒ x = 0,4a; y = 0,6a
%m HCOOH =
Bài 8: Hỗn hợp Z gồm hai axit cacbocylic đơn chức X và Y (MX > MY) có tổng khối lượng là 8,2 gam. Cho Z tác dụng vừa đủ với dung dịch NaOH, thu được dung dịch chưa 11,5 gam muối. Mặt khác, nếu cho Z tác dụng với một lượng dư dung dịch AgNO3 trong NH3, thu được 21,6 gam Ag. Công thức và phần trăm khối lượng của X trong Z là
A. C2H3COOH và 43,90%.
B. C3H5COOH và 54,88%.
C2H5COOH và 56,10%.
D. HCOOH và 45,12%.
Lời giải
Đáp án: A
1 mol Z → 1 mol muối tăng 22g
nZ = (11,5 – 8,2)/22 = 0,15
Z tác dụng được với AgNO3/NH3 ⇒ trong Z có HCOOH
nHCOOH = 1/2 nAg = 0,1 ⇒ nY = 0,05; mY = 8,2 – 0,1.46 = 3,6g
MY = 72 ⇒ Y là C2H3COOH
⇒ %mY = 43,9%
Bài 9: Cho hỗn hợp X gồm hai axit cacbocylic no, mạch không phân nhánh. Đốt chày hoàn toàn 0,3 mol hỗn hợp X, thu được 11,2 lít khí CO2 (đktc). Nếu trung hòa 0,3 mol X thì cần dùng 500ml dung dịch NaOH 1M. Hai axit đó
A. HCOOH, HOOC-COOH.
B. HCOOH, HOOC-CH2– COOH.
C. HCOOH, C2H5COOH.
D. HCOOH, CH3COOH.
Lời giải
Đáp án: A
nC trong X = = 0,5 mol
nC trong nhóm chức COOH của X = nNaOH = 0,5 mol
⇒ Trong X, C chỉ nằm trong nhóm chức COOH, không có ở gốc
⇒ HCOOH, HOOC – COOH
Bài 10: Hỗn hợp X chứa ba axit cacbocylic đều đơn chức, mạch hở, gồm một axit no và hai axit không no đều có một liên kết đôi (C=C). Cho m gam X tác dụng vừa đủ với 150 ml dung dịch NaOH 2M, thu được 25,56 gam hỗn hợp muối. Đốt cháy hoàn toàn m gam X, hấp thụ toàn bộ sản phẩm cháy bằng dung dịch NaOH dư, khối lượng dung dịch tăng thêm 40,08 gam. Tổng khối lượng của hai axit cacbocylic không no trong m gam X là
A. 9,96 gam.
B. 15,36 gam.
C. 12,06 gam.
D. 18,96 gam.
Lời giải
Đáp án: C
nNaOH = 0,3 = naxit = nmuối
Gọi CTPT axit no là CnH2nO2 (a mol); CTPT trung bình của 2 axit không no là CmH2m-2O2 (b mol)
Ta có: a + b = 0,3
a.(14n + 54) + b.(14m + 52) = 25,56
(an + bm).44 + [an + b(m – 1)].18 = 40,08
⇒ an + bm = 0,69; b = 0,15; a = 0,15 ⇒ n + m = 4,6
Dựa vào điều kiện n : nguyên dương, m > 3 ⇒ n = 1 và m = 3,6
Vậy khối lượng 2 axit không no = (14.3,6 + 30).0,15 = 12,06 (gam)
Bài 11: Số đồng phân axit ứng với công thức C4H8O2 là
A. 2.
B. 3.
C. 4.
D. 6.
Lời giải
Đáp án: A
Bài 12: Công thức chung của axit cacboxylic no, đơn chức, mạch hở là
A. CnH2nO2.
B. CnH2n+2O2.
C. CnH2n+1O2.
D. CnH2n-1O2.
Lời giải
Đáp án: A
Bài 13: Dung dịch axit axetic không phản ứng được với
A. Mg.
B. NaOH.
C. NaHCO3.
D. NaNO3.
Lời giải
Đáp án: D
Bài 14: Cho các phản ứng sau ở điều kiện thích hợp:
(1) Lên men giấm ancol etylic.
(2) Oxi hóa không hoàn toàn anđehit axetic.
(3) Oxi hóa không hoàn toàn butan.
(4) Cho metanol tác dụng với cacbon oxit.
Trong những phản ứng trên, số phản ứng tạo axit axetic là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải
Đáp án: D
Bài 15: Dãy số gồm các chất có nhiệt độ sôi tăng dần từ trái qua phải là:
A. C2H6, C2H5OH, CH3CHO, CH3COOH.
B. C2H6, CH3CHO, C2H5OH, CH3COOH.
C. CH3CHO, C2H6, C2H5OH, CH3COOH.
D. C2H6, CH3CHO, CH3COOH, C2H5OH.
Lời giải
Đáp án: B
Bài 16: Axit oxalic có vị chua của
A. giấm.
B. chanh.
C. me.
D. khế.
Lời giải
Đáp án: C
******************
Trên đây là nội dung bài học Hóa học 11 Bài 45: Axit cacboxylic do Tekmonk bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Axit cacboxylic. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: chinese.com.vn/giao-duc
Bạn đang đọc : Hóa học 11 Bài 45: Axit cacboxylic – Giải bài tập SGK Hóa học 11 Bài 45 2023 được cập nhập bởi Tekmonk.
Thông tin và kiến thức về chủ đề Hóa học 11 Bài 45: Axit cacboxylic – Giải bài tập SGK Hóa học 11 Bài 45 2023 do Học viện Công nghệ Tekmonk chọn lọc và tổng hợp cùng với các chủ đề liên quan khác.
Tham khảo thêm các khóa học công nghệ đỉnh cao tại: Học viện công nghệ Tekmonk 
Nguồn: Internet
- Anna gấu 33 livestream link facebook
- ChatGPT là gì? 6 Khóa học chat gpt cực chất 2023
- #5 Nơi Lấy Code Fifa Mobile Hàn Quốc, Code FIFA Mobile Nexon uy tín 2023
- App china Xingtu tải app Xingtu cho ios, android mới 2023❤️
- TOP 10 phần mềm học lập trình cho trẻ em tốt nhất 2022
- Top 14 nơi đào tạo lập trình cho trẻ tốt nhất 2022
- Khóa học lập trình cho trẻ em tốt nhất 2023 Hà nội, TpHCM ✅
- Lập trình ứng dụng bằng Thunkable có khó với trẻ em?
- Lập trình Game Lợi ích ít người biết đến 2022
- Kodu Game Lab – Ngôn ngữ Lập trình cho trẻ em cực chất 2023
- Sóng cơ là gì? Phân loại sóng và Đặc điểm của Sóng cơ 2023
- Top 15 bài về linh lung lang tâm tập 1 hay nhất 2023
- Hướng dẫn cài đặt và sử dụng phần mềm Aster V7 giúp nhiều người sử dụng cùng máy tính cùng lúc
- Top 15 bài về bộ 02 hay nhất 2023
- Top 18 bài về lều mông cổ hay nhất 2023
- Xem phim lật mặt 3 hay nhất 2023❤️
- Tờ 100k, Ảnh tờ Tiền 50K, Tiền 100K, 200K Hoa Tiền Cực Đẹp 2023
- Top 13 bài test tâm lý hay nhất 2023
- Cách đăng nhập Hành trang số 2023
- App, phần mềm giảm Lag khi chơi Liên Quân cho máy yếu