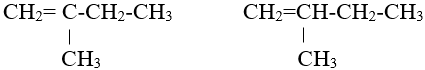Bạn đang tìm kiếm Hóa học 11 Bài 29: Anken – Giải bài tập SGK Hóa học 11 Bài 29 2023 phải không? Xin chúc mừng bạn đã tìm đúng chỗ rồi! Hãy đọc ngay bài viết dưới đây của Tekmonk
Hóa học 11 Bài 29: Anken được lyconguan.edu.vn biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 29
I. Đồng đẳng, cấu tạo
– Công thức chung: CnH2n (n ≥ 2).
– Tên gọi chung là anken hay olefin.
– Công thức đơn giản nhất là etilen (CH2=CH2).
– Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
– Trong phân tử có 1 liên kết đôi: gồm 1 liên kết σ và 1 liên kết π. Nguyên tử cacbon ở liên kết đôi tham gia 3 liên kết σ nhờ obitan lai hóa sp2, còn liên kết π nhờ obitan p không lai hóa.
– Đặc biệt phân tử CH2=CH2 có cấu trúc phẳng.
– Do có liên kết pi nên khoảng cách giữa hai nguyên tử C=C ngắn lại và nguyên tử cacbon này không thể quay quanh liên kết đôi vì khi quay như vậy liên kết π bị phá vỡ.
II. Đồng phân, danh pháp
1. Danh pháp
* Tên thông thường: Tên ankan – an + ilen
Ví dụ: CH2=CH2: etilen; CH2=CH–CH3: Propilen
* Tên thay thế: gọi tên theo cách sau:
– Chọn mạch chính là mạch C dài nhất có chứa liên kết đôi.
– Đánh số C mạch chính từ phía gần liên kết đôi hơn.
Gọi tên: vị trí nhánh – tên nhánh – tên C mạch chính – vị trí liên kết đôi – en.
CH2=CH-CH2-CH3: But–1–en.
CH3-CH=CH-CH3: But–2–en.
2. Đồng phân
a. Đồng phân cấu tạo
– Đồng phân vị trí liên kết đôi:
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
– Đồng phân mạch cacbon:
b. Đồng phân hình học
Ví dụ: But-2-en
III. Tính chất vật lý
1. Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng
– Nhiệt độ nóng chảy nhiệt độ sôi tăng dần khi tăng số nguyên tử cacbon trong phân tử: 4 chất đầu là chất khí, các chất có n từ 5 → 18 là chất lỏng, khi n≥19 là chất rắn.
– Các anken đều nhẹ hơn nước.
– Khối lượng riêng của anken không khác nhiều so với ankan và xicloankan có cùng số nguyên tử C.
2. Tính tan và màu sắc
– Đều ít tan trong nước, tan được trong một số dung môi nhưng dễ tan trong các dung môi hữu cơ (rượu, ete, …).
– Các anken không màu.
IV. Tính chất hóa học
1. Phản ứng cộng hiđro (Phản ứng hiđro hoá)
2. Phản ứng cộng halogen (Phản ứng halogen hoá)
CH2=CH2 + Br2 → Br–CH2–CH2–Br
– Anken làm mất màu của dung dịch brom → Phản ứng này dùng để nhận biết anken.
3. Phản ứng cộng nước và axit
– Cộng axit HX.
CH2=CH2 + HCl → CH3CH2Cl
– Đối với các anken khác, nguyên tử halogen (trong HX) mang điện âm, ưu tiên đính vào nguyên tử C bậc cao (theo quy tắc Maccopnhicop).
* Quy tắc Maccopnhicop: Trong phản ứng cộng HX (axit hoặc nước) vào liên kết C=C của anken, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X– (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
– Cộng nước:
4. Phản ứng trùng hợp
– Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
– Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n.
5. Phản ứng oxi hoá
– Oxi hoá hoàn toàn:
Nhận xét: Đốt anken thu nCO2 = nH2O
– Oxi hoá không hoàn toàn:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
V. Điều chế và ứng dụng
1. Điều chế
Trong phòng thí nghiệm:
Trong công nghiệp:
2. Ứng dụng
a. Tổng hợp polime
– Trùng hợp etilen, propilen, butilen người ta thu được các polime để chế tạo màng mỏng, bình chứa, ống dẫn nước, … dùng cho nhiều mục đích khác nhau.
– Chuyển hoá etilen thành các monome khác để tổng hợp ra hàng loạt polime đáp ứng nhu cầu phong phú của đời sống và kĩ thuật.
Ví dụ:
b. Tổng hợp các hoá chất khác
Từ etilen tổng hợp ra những hoá chất hữu cơ thiết yếu như etanol, etilen oxit, etylen glicol, anđehit axetic, …
Giải bài tập SGK Hóa học 11 Bài 29
Bài 1 (trang 132 SGK Hóa 11)
So sánh anken với ankan về đặc điểm cấu tạo và tính chất hóa học. Cho thí dụ minh họa.
Lời giải:
– Về đặc điểm cấu tạo: Khác với ankan là phân tử chỉ chứa liên kết σ, phân tử anken còn có chứa 1 liên kết π kém bền, dễ gẫy.
– Do đó về tính chất hóa học cũng không giống với ankan là cho phản ứng thế là phản ứng đặc trưng, anken cho phản ứng cộng là phản ứng đặc trưng
Ví dụ:
C2H4 + H2→C2H6 (xúc tác : Ni)
C2H4 + Br2→C2H4Br2
C2H4 + HBr→C2H5Br
Ngoài ra anken còn cho phản ứng trùng hợp phản ứng làm mất màu dung dịch thuốc tím.
Ví dụ :
Bài 2 (trang 132 SGK Hóa 11)
Ứng với công thức C5H10 có bao nhiêu đồng phân cấu tạo ?
A. 4
B. 5
C. 3
D. 7
Lời giải:
– Đáp án B
– Các công thức cấu tạo:
Bài 3 (trang 132 SGK Hóa 11)
Viết phương trình hóa học của phản ứng xảy ra khi:
a. Propilen tác dụng với hidro, đun nóng (xúc tác Ni).
b. But-2-en tác dụng với hirdo clorua.
c. Metylpropen tác dụng với nước có xúc tác axit.
d. Trùng hợp but-1-en.
Lời giải:
Bài 4 (trang 132 SGK Hóa 11)
Trình bày phương pháp hóa học để :
a. Phân biệt metan và etilen.
b. Tách lấy khí metan từ hỗn hợp etilen.
c. Phân biệt hai bình không dán nhãn đựng hexan và hex-1-en.
Viết phương trình hoá học của phản ứng đã dùng.
Lời giải:
a. Lần lượt cho metan và etilen đi qua dung dịch nước brom, chất nào làm dung dịch nước brom nhạt màu thì đó là etilen, chất nào không làm dung dịch nước brom nhạt màu thì đó là metan.
CH2=CH2 + Br2 → CH2Br-CH2Br
Br2(dd nâu đỏ); CH2Br-CH2Br (không màu)
CH4 không tác dụng với dung dịch nước brom
b. Cho hỗn hợp khí (CH4 và C2H4) đi qua dung dịch nước brom dư, C2H4 sẽ tác dụng với dung dịch nước brom, khí còn lại ra khỏi bình dung dịch nước brom là CH4.(PTHH như câu a)
c. Tương tự câu a
Lần lượt cho hexan và hex-1-en đi qua dung dịch nước brom, chất nào làm dung dịch nước brom nhạt màu thì đó là hex-1-en, chất nào không làm dung dịch nước brom nhạt màu thì đó là hexan
PTHH:
CH2=CH-[CH2]3-CH3 + Br2 → CH2Br-CHBr-[CH2]3-CH3
Br2(dd nâu đỏ); CH2Br-CHBr-[CH2]3-CH3 (không màu)
Hexan không tác dụng với dung dịch nước brom
Bài 5 (trang 132 SGK Hóa 11)
Chất nào sau đây làm mất màu dung dịch brom?
A. Butan
B. but-1-en
C. cacbon đioxi
D. metylpropan
Lời giải:
Đáp án B
PTHH:
CH2=CH-CH2-CH3 + Br2 → CH2Br-CHBr-CH2-CH3
Br2(dd nâu đỏ); CH2Br-CHBr-CH2-CH3(không màu)
Bài 6 (trang 132 SGK Hóa 11)
Dẫn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90gam.
a. Viết các phương trình hóa học và giải thích các hiện tượng ở thí nghiệm trên.
b. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ban đầu.
Lời giải:
a. Phương trình hóa học:
b. Gọi số mol của etilen và propilen lần lượt là x và y mol.
Khối lượng dung dịch sau phản ứng tăng lên chính là khối lượng của hỗn hợp etilen và propilen.
Ta có hệ phương trình:
Trắc nghiệm Hóa học 11 Bài 29 có đáp án
Bài 1: Hiđrocacbon nào sau đây khi phản ứng với dung dịch brom thu được 1,2- đibromtoluen?
A. But -1-en
B. butan
C. But -2-en
D. 2-metylpropen
Lời giải
Đáp án: A
Bài 2: Anken X hợp nước tạo thành 3-etylpentan-3-ol. Tên của X là
A. 3-etylpent-2-en
B. 3-etylpent-3-en
C. 3-etylpent-2-en
D. 2-etylpent-2-en
Lời giải
Đáp án: A
Bài 3: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là
A.2,240
B. 2,688
C. 4,480
D. 1,344
Lời giải
Đáp án: D
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
nKMnO4 = 0,04 mol → nC2H4 = 0,06 mol
→ V = 0,06.22,4 = 1,344 (lít)
Bài 4: Trùng hợp m tấn etilen thu được 1 tấn polietilen (PE) với hiệu suất phản ứng bằng 80%. Giá trị của m là
A.1,25
B. 0,80
C. 1,80
D. 2,00
Lời giải
Đáp án: A
m = 1.100/80 = 1,25 (tấn)
Bài 5: Ba hiđrocacbon X, Y, Z kế tiếp nhau trong dãy đồng đẳng, trong đó khối lượng phân tử Z gấp đôi khối lượng phân tử X. Đốt cháy 0,1 mol chất Y,sản phẩm khi hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư, thu được số gam kết tủa là
A.30 gam
B. 10gam
C. 40 gam
D. 20 gam
Lời giải
Đáp án: A
Phân tử Z hơn phân tử X 2 nhóm CH2 → MZ = MX + 28
→ MZ = 2MX → 2MX = MX + 28 → MX = 28 → X là C2H4
Bài 6: Dẫn từ từ 6,72 lit (đktc) hỗn hợp X gồm etilen và propilen và dung dịch brom, dung dịch brom bị nhạt màu, và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tắng 9,8 gam. Thành phần phần trăm theo thể tích của etilen trong X là
A.50,00%
B. 66,67%
C. 57,14%
D. 28,57%
Lời giải
Đáp án: B
C2H4: x mol; C3H6: y mol
⇒x + y = 0,3 mol (1)
mdung dịch sau phản ứng tăng = mX
⇒ 28x + 42y = 9,8 (2)
Từ (1)(2) ⇒ x = 0,2 mol; y = 0,1 mol
%VC2H4 = 0,2 : 0,3. 100% = 66,67%
Bài 7: Đốt cháy hoàn toàn 0,2 mol hồn hợp X gồm một ankan và một anken, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của anken có trong X là
A.40%
B. 50%
C. 25%
D. 75%
Lời giải
Đáp án: D
nankan = nH2O – nCO2 = 0,4 – 0,35 = 0,05 (mol)
nanken = 0,2 – 0,05 = 0,15 mol → %Vnanken = 0,15/0,2 .100% = 75%
Bài 8: Một hiđrocacbon X cộng hợp với axit HCl theo tỷ lệ mol 1 : 1 tạo sản phẩm có thành phần khối lượng clo là 45,223 %. Công thức phân tử của X là
A.C4H8
B. C3H6
C. C3H8
D. C2H4
Lời giải
Đáp án: B
X + HCl → Y (CxHyCl)
35,5/MY. 100% = 45,223% → MY = 78,5 → MX = 78,5 – 36,5 = 42 (C3H6)
Bài 9: Cho Hiđrocacbon X phản ứng với brom(trong dung dịch) theo tỷ lệ mol 1 : 1 thì được chất hữu cơ Y(chứ 74,08% brom về khối lượng). Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau. Tên gọi của X là
A. but-1-en
B.etilen
C. but-2-en.
D. propilen
Lời giải
Đáp án: A
X + Br2 → Y (CxHyBr2)
80.2/MY . 100% = 74,08% → MY = 216 → MX = 216 – 160 = 56 (C4H8)
Bài 10: Hỗn hợp X gồm H2 và C2H4 có tỷ khối so với He là 3,75. Dẫn X qua nung nóng, thu được hỗn hợp khí Y có khối lượng so với He là 5. Hiệu xuất của phẩn ứng hiđro hóa là
A.20%
B. 25%
C. 50%
D. 40%
Lời giải
Đáp án: C
MX = 15 ⇒ nH2 : nC2H4 = 1 : 1 (Hiệu suất tính theo 1 trong 2)
Giả sử X có 1mol H2 và 1 mol C2H4
H2 + C2H4 –to, xt→ C2H6
Bảo toàn khối lượng: mX = mY
⇒ CnH2n-2
⇒ nY = 2 : 4/3 = 1,5 mol
Ta có n khí giảm = nX – nY = nH2 pư = 2 – 1,5 = 0,5 mol
⇒ H% = 0,5 : 1. 100% = 50%
Bài 11: Chất X có công thức CH3 – CH(CH3) – CH = CH2. Tên thay thế của X là
A. 2-metylbut-3-en
B. 3-metylbut-1-in.
C. 3-metylbut-1-en
D. 2-metylbut-3-in
Lời giải
Đáp án: C
Bài 12: Chất nào sau đây có đồng phân hình học?
A. but-1-en
B. but-2-en.
C. 1,2-dicloetan
D. 2-clopropen
Lời giải
Đáp án: B
Bài 13: Chất nào sau đây có đồng phân hình học?
A. CH2= CH – CH2– CH3
B. CH3 – CH – C(CH3)2.
C. CH3– CH = CH – CH2– CH3
D. (CH3)2 – CH – CH = CH2
Lời giải
Đáp án: C
Bài 14: Ứng với công thức phân tử C4H8 có bao nhiêu đồng phân cấu tạo mạch hở?
A.2
B. 4
C. 3
D. 5
Lời giải
Đáp án: C
Bài 15: Ứng với công thức phân tử C4H10 có bao nhiêu đồng phân cấu tạo mạch hở?
A.4
B. 5
C. 6
D. 3
Lời giải
Đáp án: B
Bài 16: Số liên kết σ có trong một phân tử But -1-en là
A.13
B. 10
C.12
D. 11
Lời giải
Đáp án: D
******************
Trên đây là nội dung bài học Hóa học 11 Bài 29: Anken do lyconguan.edu.vn biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Anken. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: lyconguan.edu.vn
Bạn đang đọc : Hóa học 11 Bài 29: Anken – Giải bài tập SGK Hóa học 11 Bài 29 2023 được cập nhập bởi Tekmonk.
Thông tin và kiến thức về chủ đề Hóa học 11 Bài 29: Anken – Giải bài tập SGK Hóa học 11 Bài 29 2023 do Học viện Công nghệ Tekmonk chọn lọc và tổng hợp cùng với các chủ đề liên quan khác.
Tham khảo thêm các khóa học công nghệ đỉnh cao tại: Học viện công nghệ Tekmonk 
Nguồn: Internet
- Anna gấu 33 livestream link facebook
- ChatGPT là gì? 6 Khóa học chat gpt cực chất 2023
- #5 Nơi Lấy Code Fifa Mobile Hàn Quốc, Code FIFA Mobile Nexon uy tín 2023
- App china Xingtu tải app Xingtu cho ios, android mới 2023❤️
- TOP 10 phần mềm học lập trình cho trẻ em tốt nhất 2022
- Top 14 nơi đào tạo lập trình cho trẻ tốt nhất 2022
- Khóa học lập trình cho trẻ em tốt nhất 2023 Hà nội, TpHCM ✅
- Lập trình ứng dụng bằng Thunkable có khó với trẻ em?
- Lập trình Game Lợi ích ít người biết đến 2022
- Kodu Game Lab – Ngôn ngữ Lập trình cho trẻ em cực chất 2023
- Nhận Kim Cương Miễn Phí Từ Garena 2023. Nhận KC Free Garena FF
- Cách Lấy Gear 4 King Legacy 2023 trên điện thoại
- Vision 2022 màu đỏ giá bao nhiêu
- Cách sử dụng Google Docs đơn giản và hiệu quả nhất
- Tìm hiểu game Loserchick (CHICK) là gì? Review và hướng dẫn chơi game LoserChick
- Top 10 vở bài tập toán lớp 3 bài 36 trang 45 2022
- Lập trình là gì? Học lập trình có khó không? 6 Ưu nhược điểm
- Trẻ em nên bắt đầu với lập trình từ đâu trong năm 2022
- 7 cách biến smartphone thành máy tính PC
- Dặm bằng bao nhiêu kilomet