Bạn đang tìm kiếm Cách viết công thức Lewis đơn giản, dễ hiểu nhất 2023 phải không? Xin chúc mừng bạn đã tìm đúng chỗ rồi! Hãy đọc ngay bài viết dưới đây của Tekmonk
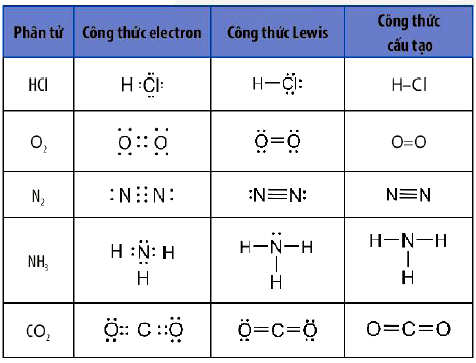
Công thức Lewis dùng để biểu diễn sự hình thành liên kết hoá học giữa các nguyên tử trong một phân tử. Công thức Lewis của một phần tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “–“.
Ví dụ: Viết công thức Lewis của SO2, SO3, N2, NO2, HNO3, H2S, SF6, C2H2…
Viết Công thức Lewis của HCN
Bước 1: C có 4 electron hóa trị, H có 1 electron hóa trị, N có 5 electron hóa trị.
⇒ Tổng số electron hóa trị là: 4 + 1 + 5 = 10 electron.
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử HCN
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 10 – 2 × 2 = 6 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 6 electron này để tạo octet cho N trước
Bước 4: Đã sử dụng hết 6 electron để tạo octet cho N. Tuy nhiên C chưa đủ octet nên ta chuyển 2 cặp electron của nguyên tử N tạo thành cặp electron dùng chung giữa C và N. Nguyên tử H đã đủ octet
Vậy công thức Lewis của HCN là:
Viết Công thức Lewis của SO3
+ Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị là: 1.6 + 3.6 = 24 electron
+ Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử SO3
S có độ âm điện nhỏ hơn nên S là nguyên tử trung tâm.
+ Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 24 – 2.3 = 18 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 18 electron này để tạo octet cho O trước (vì O có độ âm điện cao hơn)
+ Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
Công thức Lewis của SO3 là:
Viết Công thức Lewis của NH3
Bước 1. Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2. Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.
Viết Công thức Lewis của N2
+ Bước 1. Số electron hóa trị là 5.2 = 10 electron
+ Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
+ Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
+ Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = – 4
– Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là:
Viết Công thức Lewis của SO2
+ Bước 1. Số electron hóa trị là 1.6 + 2.6 = 18 electron.
+ Bước 2. Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh:
+ Bước 3. Hoàn thiện octet cho nguyên tử O:
+ Bước 4. Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
Công thức Lewis của SO2 là:
Viết Công thức Lewis của nitric acid HNO3
Bước 1: N có 5 electron hóa trị, O có 6 electron hóa trị, H có 1 electron hóa trị. Trong phân tử HNO3, có 1 nguyên tử H, 3 nguyên tử O và 1 nguyên tử N
⇒ Tổng số electron hóa trị N1 = 1.1 + 3.6 + 1.5 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 8 = 16 electron
Bước 3: Sử dụng N3 = 16 electron để tạo octet cho O trước
Bước 4: Đã sử dụng hết 16 electron để tạo octet cho O. Tuy nhiên N chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O bên phải tạo thành cặp electron dùng chung.
Chung cho hai nguyên tử O và N
Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
– Phân tử CS2: Mỗi nguyên tử S sẽ góp chung 2 electron mới nguyên tử C tạo thành 4 cặp electron dùng chung được biểu thị bằng 4 gạch nối.
– Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
– Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron với nguyên tử C để tạo thành 4 cặp electron dùng chung.
*****************
Trên đây là bài học về Công thức Lewis chi tiết, đầy đủ nhất. Hy vọng các em đã biết cách viết công thức Lewis của các phân tử. Chúc các em học tốt và đạt điểm cao trong các bài thi, bài kiểm tra nhé.
Bạn đang đọc : Cách viết công thức Lewis đơn giản, dễ hiểu nhất 2023 được cập nhập bởi Tekmonk.
Thông tin và kiến thức về chủ đề Cách viết công thức Lewis đơn giản, dễ hiểu nhất 2023 do Học viện Công nghệ Tekmonk chọn lọc và tổng hợp cùng với các chủ đề liên quan khác.
Tham khảo thêm các khóa học công nghệ đỉnh cao tại: Học viện công nghệ Tekmonk 
Nguồn: Internet
- Anna gấu 33 livestream link facebook
- ChatGPT là gì? 6 Khóa học chat gpt cực chất 2023
- #5 Nơi Lấy Code Fifa Mobile Hàn Quốc, Code FIFA Mobile Nexon uy tín 2023
- App china Xingtu tải app Xingtu cho ios, android mới 2023❤️
- TOP 10 phần mềm học lập trình cho trẻ em tốt nhất 2022
- Top 14 nơi đào tạo lập trình cho trẻ tốt nhất 2022
- Khóa học lập trình cho trẻ em tốt nhất 2023 Hà nội, TpHCM ✅
- Lập trình ứng dụng bằng Thunkable có khó với trẻ em?
- Lập trình Game Lợi ích ít người biết đến 2022
- Kodu Game Lab – Ngôn ngữ Lập trình cho trẻ em cực chất 2023
- Ví điện tử VNPAY là gì? Cách sử dụng ví điện tử VNPAY 2022
- Ngôn ngữ Python có khó với học sinh cấp 3 không?
- Top 27 bài về gạo lứt sấy rong biển hay nhất 2023
- Đức mẹ tà pao ở đâu
- Cách khoanh tròn, làm trắc nghiệm đáp án trong Word, Powerpoint, Excel
- Hướng dẫn quay màn hình, video game bằng phần mềm Bandicam
- Top 23 bài về 62 trần quang khải hay nhất 2023
- Khương Tử Nha trong phim Tân Bảng Phong thần tên thật là gì 2023
- Nắm bắt Công nghệ, GenZ làm chủ tương lai
- Top 1994 mệnh gì hay nhất